Un nuevo estudio de la Universidad Hebrea de Jerusalem revela que el movimiento bacteriano juega un papel central en la transferencia de genes de resistencia a los antibióticos.
Un nuevo estudio de la Facultad de Medicina de la Universidad Hebrea de Jerusalem descubrió cómo el movimiento bacteriano influye en la propagación de la resistencia a los antibióticos.
Dirigida por la profesora Sigal Ben-Yehuda y el profesor Ilan Rosenshine del Departamento de Microbiología y Genética Molecular, la investigación descubre una conexión directa entre la rotación de los flagelos bacterianos (estructuras utilizadas para el movimiento) y la activación de los genes que permiten a las bacterias transferir ADN entre sí.
Este proceso, conocido como conjugación bacteriana, es un mecanismo clave por el cual los rasgos genéticos, en particular la resistencia a los antibióticos, se comparten entre las poblaciones bacterianas. Si bien la conjugación se ha asociado tradicionalmente con las bacterias que se adhieren a las superficies sólidas, el equipo investigó pLS20, un plásmido conjugativo generalizado en las especies de Bacilos, que se comporta de manera diferente.
El estudio muestra que, en ambientes líquidos, donde las bacterias dependen del movimiento para navegar, la rotación de los flagelos actúa como una señal mecánica que activa un conjunto de genes necesarios para la transferencia de ADN.
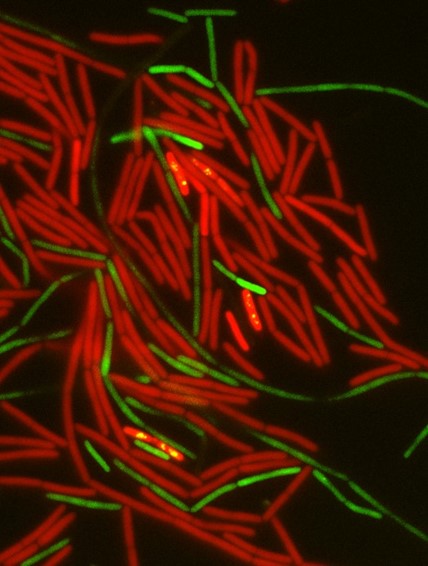
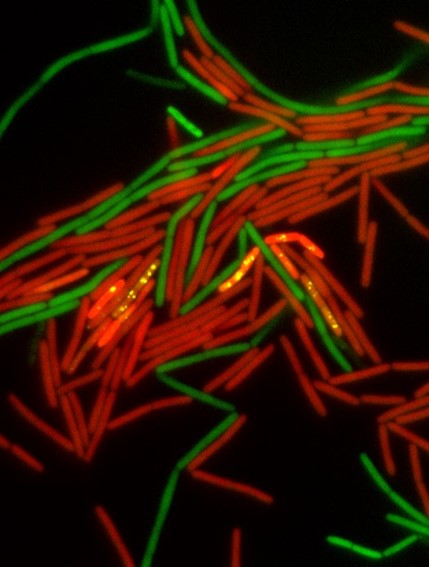
Los investigadores descubrieron que esta señal desencadena la expresión génica en un subconjunto específico de células donantes, que luego forman grupos con las bacterias receptoras. Estos grupos multicelulares ponen en estrecho contacto a los dos tipos de células, lo que facilita la transferencia de material genético. Es importante destacar que el estudio demuestra que no es solo la presencia de flagelos, sino su capacidad para rotar, lo que es crítico.
Cuando se interrumpió la rotación flagelar, ya sea genéticamente o aumentando la viscosidad del medio circundante, la actividad de conjugación disminuyó significativamente. Esto sugiere que la motilidad bacteriana no solo es importante para el movimiento, sino que también sirve como una señal de detección mecanométrica para el intercambio genético.
“Nuestro estudio aporta una noción novedosa de que la sincronización de la transferencia de ADN con el estilo de vida móvil bacteriano proporciona al plásmido la ventaja de propagarse a nichos ecológicos remotos”, dijo la profesora Sigal Ben-Yehuda.
Estos hallazgos proporcionan información valiosa sobre cómo los elementos genéticos móviles se sincronizan con la fisiología del huésped para mejorar su propia transmisión. La comprensión de estos mecanismos puede ayudar a desarrollar nuevas estrategias para limitar la propagación de la resistencia a los antibióticos, un importante problema de salud pública.
Conjugación bacteriana: Las bacterias donantes (verde) atraen a las bacterias receptoras (rojo) a los grupos de apareamiento. Los eventos de conjugación se representan como bacterias rojas que muestran puntos amarillos. | Crédito: Michael Bejerano-Sagie y Saurabh Bhattacharya.
El artículo de investigación titulado “Flagellar rotation facilitates the transfer of a bacterial conjugative plasmid”, ya está disponible en The EMBO Journal.
Investigadores:
Saurabh Bhattacharya, Michal Bejerano-Sagie, Miriam Ravins, Liat Zeroni, Prabhjot Kaur, Venkadesaperumal Gopu, Ilan Rosenshine, Sigal Ben-Yehuda.
Departamento de Microbiología y Genética Molecular, Instituto de Investigación Médica Israel-Canadá (IMRIC), Escuela de Medicina Universidad Hebrea-Hadassah.