Un nuevo estudio de la Universidad Hebrea revela información sobre la regulación del ARNm durante el desarrollo embrionario. El estudio combina la secuenciación de ARN de una sola célula y el marcaje metabólico en embriones de pez cebra, distinguiendo entre ARNm recién transcrito y preexistente. Este enfoque cuantifica las tasas de transcripción y degradación del ARNm dentro de los tipos de células individuales, descubriendo tasas reguladoras variadas entre los genes y las diferencias específicas del tipo de célula en la degradación. Comprender la regulación del ARNm durante el desarrollo embrionario ayuda a descifrar cómo se activan y desactivan los genes en células específicas en momentos precisos, lo que informa nuestra comprensión del desarrollo, las decisiones sobre el destino celular y las posibles aplicaciones en medicina y biología.
Un nuevo estudio dirigido por la estudiante de doctorado Lior Fishman y su equipo bajo la dirección de la investigadora Dra. Michal Rabani del Instituto Alexander Silberman de Ciencias de la Vida de la Universidad Hebrea, y en colaboración con investigadores de los Institutos Nacionales de Salud de los EE. UU., arroja luz sobre el intrincado proceso de regulación del ARNm durante el desarrollo embrionario. proporcionando nuevos conocimientos sobre cómo las células pluripotentes adoptan identidades especializadas a través de la expresión génica.
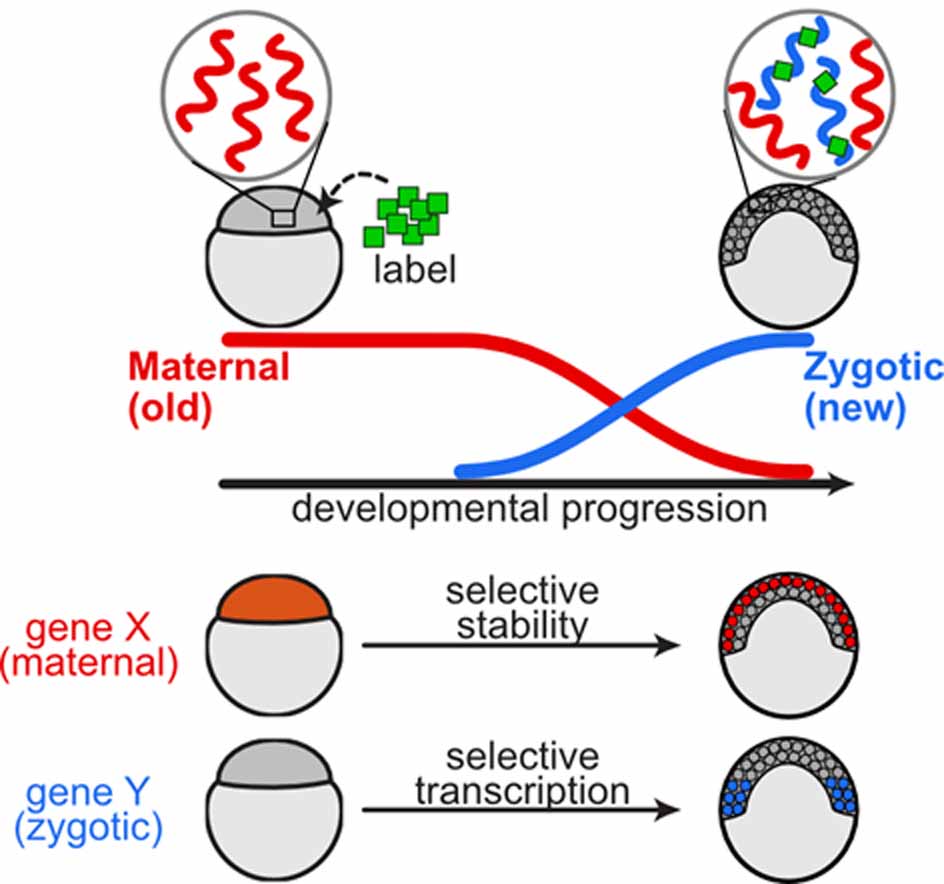
El desarrollo embrionario implica que las células pluripotentes asuman identidades especializadas mediante la adopción de perfiles de expresión génica particulares. Sin embargo, comprender las contribuciones relativas de la transcripción y degradación del ARNm a la configuración de estos perfiles ha sido un desafío, particularmente dentro de embriones con diversas identidades celulares.
En el estudio, los investigadores utilizaron una técnica llamada secuenciación de ARN de una sola célula junto con el etiquetado metabólico para rastrear cómo los genes se activan y desactivan a lo largo del tiempo en embriones de pez cebra. Podían distinguir el ARNm que se había hecho nuevo (del propio embrión) y el ARNm que ya estaba allí (de la madre). Usando modelos matemáticos, midieron qué tan rápido se activaban y desactivaban los genes en diferentes tipos de células a medida que se desarrollaban.
Los resultados del estudio revelan tasas reguladoras muy variadas en miles de genes. Los investigadores observaron tasas coordinadas de transcripción y destrucción para muchas transcripciones y vincularon las diferencias en la degradación a elementos específicos de la secuencia. Es importante destacar que identificaron diferencias específicas de tipo celular en la degradación, incluida la retención selectiva de transcripciones maternas dentro de las células germinales primordiales y las células de la capa envolvente, dos de los primeros tipos de células especificados.
La Dra. Michal Rabani, autora principal, comentó: “Nuestro estudio proporciona un enfoque cuantitativo para estudiar la regulación del ARNm durante una respuesta espacio-temporal dinámica. Este trabajo abre nuevas vías para comprender los mecanismos moleculares que subyacen a la determinación del destino celular durante el desarrollo embrionario”.
Los hallazgos de este estudio contribuyen a una comprensión más profunda de la regulación del ARNm y su papel en la configuración de las identidades celulares durante el desarrollo embrionario. El equipo de investigación espera que su trabajo allane el camino para futuros estudios destinados a desentrañar las complejidades de la regulación de la expresión génica en diversos contextos biológicos.
El artículo de investigación titulado “Cell-type-specific mRNA transcription and degradation kinetics in zebrafish embryogenesis from metabolically labeled single-cell RNA-seq”, ya está disponible en Nature.
Investigadores:
Lior Fishman1, Avani Modak2, Gal Nechooshtan1, Talya Razin1, Florian Erhard3.4, Aviv Regev5.6, Jeffrey A. Farrell2, Michal Rabani1.
Instituciones:
1) Departamento de Genética, Instituto Silberman de Ciencias de la Vida, Universidad Hebrea de Jerusalem, Campus Edmond J. Safra.
2) División de Biología del Desarrollo, Instituto Nacional de Salud Infantil y Desarrollo Humano Eunice Kennedy Shriver, NIH.
3) Instituto de Virología e Inmunobiología, Universidad de Würzburg.
4) Catedrático de Inmunología Computacional, Universidad de Ratisbona.
5) Departamento de Biología, MIT.
6) Observatorio de Células Klarman, Instituto Broad del MIT y Harvard, Cambridge.