Un estudio reciente publicado en la revista científica Nature ha revelado una línea de tiempo detallada de la dinámica materna y fetal durante la primera mitad del embarazo humano.
La investigación, realizada en la Universidad de Stanford, y en colaboración con científicos de la Universidad Hebrea de Jerusalem nos ayuda a comprender cómo las células fetales extrañas logran invadir el útero de la madre mientras escapan de la respuesta inmune materna, incluso cuando muchas células inmunes potentes se encuentran muy cerca.
Además, el estudio se centra en la remodelación de la arteria espiral (SAR), el proceso de transformación de los vasos sanguíneos maternos durante el embarazo que es fundamental para el desarrollo normal de la placenta.
Los hallazgos del estudio ofrecen información valiosa sobre los complejos mecanismos subyacentes al desarrollo del embarazo y podrían conducir a avances en las complicaciones obstétricas relacionadas con la placenta, como la preeclampsia y el parto prematuro.
Durante el embarazo normal, las arterias espirales maternas, que normalmente están enrolladas y constreñidas, se dilatan extensamente para convertirse en vasos flácidos anchos que pueden transferir el flujo sanguíneo de baja velocidad y presión a la placenta (este proceso, por ejemplo, no ocurre sin problemas en la preeclampsia).
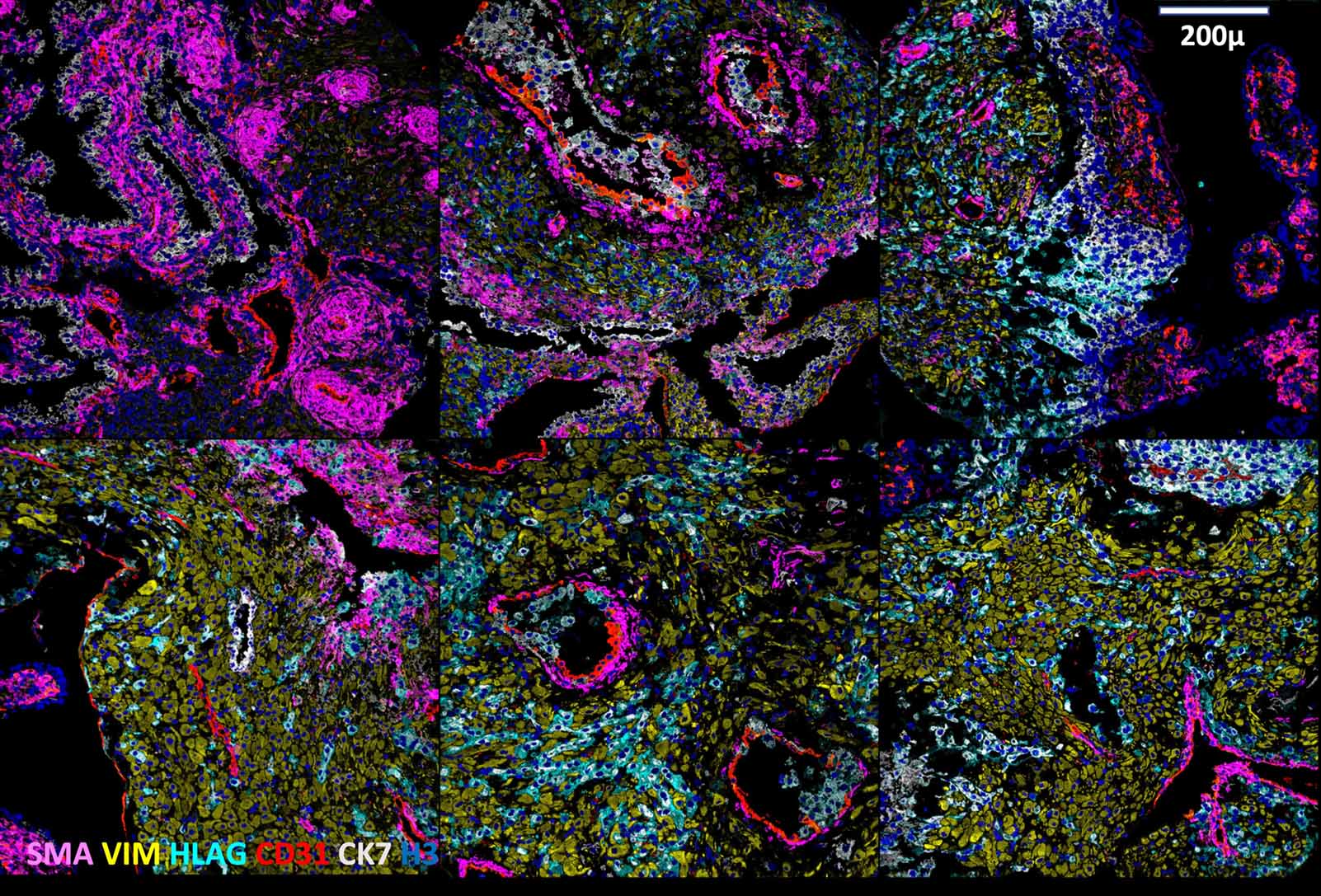
Utilizando imágenes de haz de iones multiplexadas por tiempo de vuelo (MIBI-TOF), el equipo examinó alrededor de 500.000 células y 588 arterias en la decidua intacta (que es el borde entre los lados materno y fetal en la placenta) de 66 muestras de interrupciones del embarazo no indicadas médicamente. MIBI permite la detección de hasta 40 marcadores simultáneamente a nivel de celda única y captura los datos espaciales: un nivel de resolución completamente nuevo.
Este enfoque les permitió obtener una comprensión detallada de los cambios que ocurren en el tejido en diferentes etapas del embarazo.
“Esta investigación representa un gran salto adelante en nuestra comprensión de la interfaz materno-fetal. Al combinar datos espaciales junto con datos MIBI, podemos caracterizar todas las poblaciones celulares en la interfaz materno-fetal y capturar las proteínas que están expresando. Podemos usar estos datos para desentrañar las complejas interacciones entre las células fetales extrañas y las células inmunes maternas. Podemos abordar preguntas desconcertantes como ¿Por qué las células inmunes maternas no atacan las células fetales extrañas? y ¿Qué impulsa los cambios dramáticos que vemos en la estructura de los vasos maternos?” dijo la investigadora principal Shirley Greenbaum de la Universidad Hebrea de Jerusalem.
Los hallazgos clave del estudio incluyen:
La edad del embarazo (edad gestacional) tiene un gran impacto en la composición de las poblaciones de células inmunes maternas en la decidua. Comenzando con una abundancia de células asesinas naturales (NK), a medida que avanza el embarazo, los macrófagos se vuelven cada vez más dominantes. Además, los tipos específicos de células que promueven la tolerancia (subconjuntos de células tolerogénicas) se vuelven más abundantes y se encuentran más cerca unas de otras. Esto indica que el entorno inmunológico cambia con el tiempo para apoyar al feto en desarrollo y prevenir reacciones dañinas.
Las células fetales están impulsando la remodelación de la arteria materna. Uno de los procesos que son el sello distintivo del desarrollo normal de la placenta y el embarazo saludable son la remodelación de las arterias en espiral. En contraste, en muestras de embarazos preeclámpticos, las arterias a menudo permanecen constreñidas y conservan su gruesa capa muscular. Utilizando los datos de células individuales generados por MIBI, el equipo pudo establecer la relación entre la invasión de células fetales a estas arterias y la remodelación de los vasos invadidos.
Sorprendentemente, encontraron que el proceso de remodelación de la arteria materna no fue impulsado por las células inmunes maternas adyacentes, sino más bien por la invasión de las células fetales. Esto implica que, tal vez, es el feto el que está impulsando la remodelación de las arterias de su madre, y no la madre. Debido a que la remodelación anormal de las arterias es una característica patológica de la preeclampsia, estos hallazgos pueden conducir a una mejor comprensión de esta enfermedad.
A medida que se lleva a cabo la remodelación de la arteria espiral, las vías genéticas específicas juegan un papel crucial. El estudio identificó 78 vías de este tipo que mostraron patrones únicos de cambio a lo largo del tiempo, algunos aumentando constantemente (monótono) y otros cambiando en dos fases distintas (bifásica).
Descubrieron que a medida que las células fetales invaden el útero, activan ciertos procesos beneficiosos. Estos incluyen promover el crecimiento de nuevos vasos sanguíneos (pro-angiogénicos) y regular el sistema inmunológico para prevenir cualquier reacción dañina (inmunorregulador). Estos cambios ayudan a las células fetales a interactuar con los vasos sanguíneos maternos sin desencadenar una respuesta inmune de las células inmunes de la madre. Este proceso coordinado asegura un embarazo saludable al permitir que el feto reciba los nutrientes y el oxígeno necesarios sin enfrentar el rechazo del sistema inmunológico de la madre.
La investigación ha creado un mapa único y detallado (atlas espaciotemporal) de las interacciones entre la madre y el feto en las primeras etapas del embarazo. Este atlas nos da una comprensión extraordinaria de cómo ocurren estas interacciones.
Los descubrimientos realizados en este estudio podrían llenar un vacío de conocimiento actual con respecto al desarrollo normal de la placenta.
El grupo ahora está trabajando en la implementación de estos hallazgos para examinar muestras de embarazos preeclámpticos. La publicación de este estudio marca un hito importante en la investigación de la biología reproductiva y ofrece la esperanza de mejorar los resultados de salud materna y fetal en el futuro.
El artículo fue publicado en Nature.
El equipo de investigación está compuesto por:
Departamento de Obstetricia y Ginecología, Centro Médico de la Universidad Hebrea Hadassah–Programa de Inmunología: Shirley Greenbaum.
Departamento de Patología, Universidad de Stanford: Shirley Greenbaum, Inna Averbukh, Erin Soon, Alex Baranski, Noah F. Greenwald, Adam Kagel, Marc Bosse, Zumana Khair, Shirley Kwok, Shiri Warshawsky, Hadeesha Piyadasa, Mako Goldston, Angie Spence, Matt van de Rijn y Michael Angelo.
Departamento de Patología, Universidad de California San Francisco: Gabrielle Rizzuto.
Programa de Biología del Cáncer, Universidad de Stanford: Noah F. Greenwald.
Departamento de Ginecología Obstétrica y Ciencias Reproductivas, Universidad de California en San Francisco: Eleni G. Jaswa.
División de Biología y Bioingeniería, Instituto de Tecnología de California: Geneva Miller, Morgan Schwartz, Will Graf y David Van Valen.
Departamento de Obstetricia y Ginecología, Universidad de Stanford: Virginia D. Winn.
Departamento de Patología, Memorial Sloan Kettering Cancer Center, Nueva York: Travis Hollmann.
Departamento de Biología Celular Molecular, Instituto Weizmann de Ciencias: Leeat Keren.