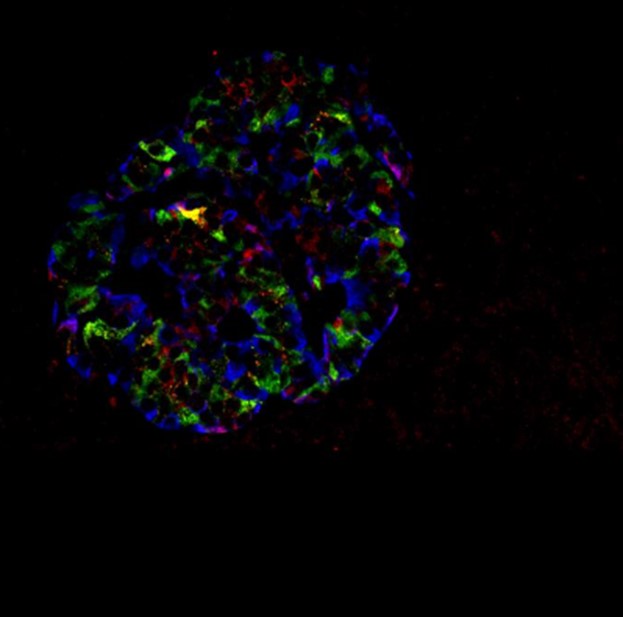
El gen G6PC2 juega un papel importante en la regulación del glucagón, una hormona que eleva los niveles de azúcar en la sangre. Ayuda a establecer el punto en el que los niveles de azúcar en la sangre impiden que se libere glucagón.
Un nuevo estudio dirigido por la Dra. Dana Avrahami-Tzfati de la Facultad de Medicina de la Universidad Hebrea, el Dr. Benjamin Glaser del Centro Médico Hadassah y el Dr. Klaus H. Kaestner de la Escuela de Medicina Perelman de la Universidad de Pensilvania, descubrió un papel fundamental de la enzima glucosa-6-fosfatasa 2 (G6PC2) en la regulación de los niveles de azúcar en la sangre.
La investigación arroja nueva luz sobre cómo esta enzima influye en la secreción de glucagón en las células alfa pancreáticas (α), un proceso crucial para mantener niveles saludables de azúcar en la sangre.
El glucagón es una hormona producida por α células del páncreas. Trabaja junto con la insulina para regular los niveles de azúcar en la sangre, elevándolos cuando bajan demasiado. Sin embargo, en las personas con diabetes tipo 2 (DT2), los niveles de glucagón suelen estar elevados, lo que contribuye a las dificultades para controlar el azúcar en la sangre.
El estudio proporciona nuevos conocimientos sobre cómo G6PC2, un gen asociado con los niveles de azúcar en sangre en ayunas, desempeña un papel en este proceso. Los investigadores descubrieron que:
- Las variaciones genéticas en G6PC2 impactan en su expresión en α células.
• En ratones que carecen del gen G6pc2 específicamente en las células α, la glucosa suprime de manera más efectiva la secreción de glucagón, lo que respalda un papel para G6pc2 en la regulación de la supresión de la secreción de glucagón en respuesta a la glucosa.
• Estos hallazgos se confirmaron en células de α humano, lo que pone de manifiesto su relevancia para la fisiología humana.
• Al demostrar que G6PC2 ayuda a definir el “punto de ajuste” en el que la glucosa suprime la secreción de glucagón, el estudio sugiere nuevas posibilidades terapéuticas. Dirigirse a G6PC2 podría conducir a tratamientos innovadores que aborden los desequilibrios de insulina y glucagón en la diabetes.
La Dra. Dana Avrahami-Tzfati destacó las implicaciones más amplias del estudio: “Nuestros hallazgos muestran que la enzima G6PC2 ayuda a controlar la liberación de glucagón al detectar los niveles de glucosa en α células. Por lo tanto, este estudio ofrece una nueva estrategia terapéutica de inhibición de G6PC2 para ayudar a controlar el azúcar en la sangre en diabéticos al aumentar simultáneamente la insulina y reducir el glucagón”.
El Dr. Klaus H. Kaestner agregó: “Esta investigación descubre un mecanismo crítico que ayuda a mantener el equilibrio del azúcar en la sangre, acercándonos a la comprensión de las complejidades de la diabetes y cómo podemos abordarla de manera más efectiva”.
El Dr. Benjamin Glaser añade una perspectiva clínica: “La mayoría de los enfoques de tratamiento actuales se centran en aumentar los niveles de insulina o la acción de la insulina, sin dirigirse directamente al glucagón. La inhibición de G6PC2 es diferente en que se dirige a ambas hormonas simultáneamente, lo que podría mejorar el efecto terapéutico”.
El estudio proporciona una base sólida para una mayor exploración de G6PC2 como objetivo terapéutico, con el potencial de mejorar significativamente el control de la diabetes.
El artículo de investigación titulado “G6PC2 controls glucagon secretion by defining the setpoint for glucose in pancreatic a cells”, ya está disponible en Science Translational Medicine.
Investigadores:
Varun BahI1,2, Reut Rifkind5, Eric Waite1,2, Zenab Hamdan5, Catherine Lee May1,2,7, Elisabetta Manduchi1,2, Benjamin F. Voight1,2,3,4, Michelle Y. Lee1,2, Mark Tigue1,2, Nicholas Manuto1,2, Benjamin Glaser, Dana Avrahami6, Klaus H. Kaestner1,2,7.
Instituciones:
1. Instituto de Diabetes, Obesidad y Metabolismo, Facultad de Medicina Perelman, Universidad de Pensilvania.
2. Departamento de Genética, Facultad de Medicina Perelman, Universidad de Pensilvania.
3. Departamento de Farmacología de Sistemas y Terapéutica Traslacional, Facultad de Medicina Perelman, Universidad de Pensilvania.
4. Instituto de Medicina Traslacional y Terapéutica, Facultad de Medicina Perelman, Universidad de Pensilvania.
5. Departamento de Endocrinología y Metabolismo, Facultad de Medicina Universidad Hebrea-Hadassah, Universidad Hebrea de Jerusalem.
6. Departamento de Biología del Desarrollo e Investigación del Cáncer, Facultad de Medicina Universidad Hebrea-Hadassah.
7. Programa de Análisis del Páncreas Humano (RRID:SCR_016202).
Financiación
Este trabajo fue apoyado por subvenciones de los NIH, el Premio Ruth L. Kirschstein, del Servicio Nacional de Investigación (NRSA), la Fundación Binacional de Ciencias entre Estados Unidos e Israel, la Fundación de Ciencias de Israel y la Fundación de Investigación de la Diabetes Juvenil.