Una forma de entrar: el estado recientemente identificado en las bacterias tiene importantes implicaciones para el tratamiento con antibióticos y las cepas resistentes.
Durante casi dos años, las fuentes de noticias nos han mantenido actualizados sobre la batalla diaria para aniquilar el coronavirus. Por lo tanto, es fácil olvidar que también hay muchos tipos de bacterias que amenazan la salud humana: nuestra supervivencia depende de la búsqueda constante de nuevos antibióticos que puedan destruirlas. Investigaciones recientes proporcionan una visión importante de la compleja respuesta de las bacterias a los antibióticos y abren la posibilidad de desarrollar una clase de medicamentos novedosa y más efectiva para combatir las principales enfermedades bacterianas.
Los antibióticos se dividen en dos categorías: los bactericidas que matan las bacterias y los que son bacteriostáticos. Estos últimos interrumpen el funcionamiento normal de las bacterias para que ya no puedan multiplicarse, dejando que nuestro sistema inmunológico proporcione el golpe letal final. Ambos antibióticos empujan a las bacterias a un estado cercano a la muerte antes de su eliminación final. Bajo este estrés potencialmente mortal, según una investigación de la Universidad Hebrea de Jerusalem, dirigida por la profesora Nathalie Q. Balaban y el estudiante de doctorado Yoav Kaplan, las bacterias entran en un estado “interrumpido” cuando funcionan de manera muy diferente a las bacterias normales. Los innovadores hallazgos se publicaron en Nature.
Cuando se elimina el estrés, las bacterias no se desvanecen y mueren, sino que eventualmente se recuperan y se reproducen, y cada célula individual se comporta de una manera diferente de sus células vecinas genéticamente idénticas. Mientras están en el estado “interrumpido”, las bacterias no responden a nuestro arsenal actual de antibióticos, que solo han sido diseñados para tratar bacterias en su estado normal. “Las bacterias en el estado interrumpido requieren un tratamiento que es diferente de nuestro arsenal actual de antibióticos”, compartió Balaban. “Ahora estamos comenzando a investigar nuevos agentes farmacológicos que pueden derrotar a las bacterias durante el estado interrumpido”.
Si bien las bacterias son organismos unicelulares, son extraordinariamente complejas. Al igual que las células individuales dentro de cualquier organismo, son capaces de autorregularse cuando se someten a diversas tensiones. Por ejemplo, si aumenta la temperatura, las bacterias producirán proteínas que protegen a la célula del calor. Restrinja su ingesta de nutrientes y las células se adaptarán para que la célula pueda sobrevivir y volver a crecer cuando los nutrientes estén disponibles. Muchas de estas respuestas han sido analizadas y los mecanismos adoptados por la célula son bien entendidos. Sin embargo, cuando el estrés es repentino y severo, estas respuestas no se activan y los mecanismos que controlan el comportamiento de las células siguen siendo un misterio.
El equipo de Balaban había demostrado previamente que una subpoblación de bacterias entrará en un estado congelado o latente cuando se someta a inanición y eventualmente, en un ambiente rico en nutrientes, se recuperará por completo y volverá a crecer. Estas bacterias “persistentes” son muy diferentes de las bacterias “resistentes”, que han desarrollado una mutación genética que les impide sucumbir a un antibiótico en particular. Además, a pesar de la extensa investigación, no hay una comprensión clara de los mecanismos que controlan la persistencia.
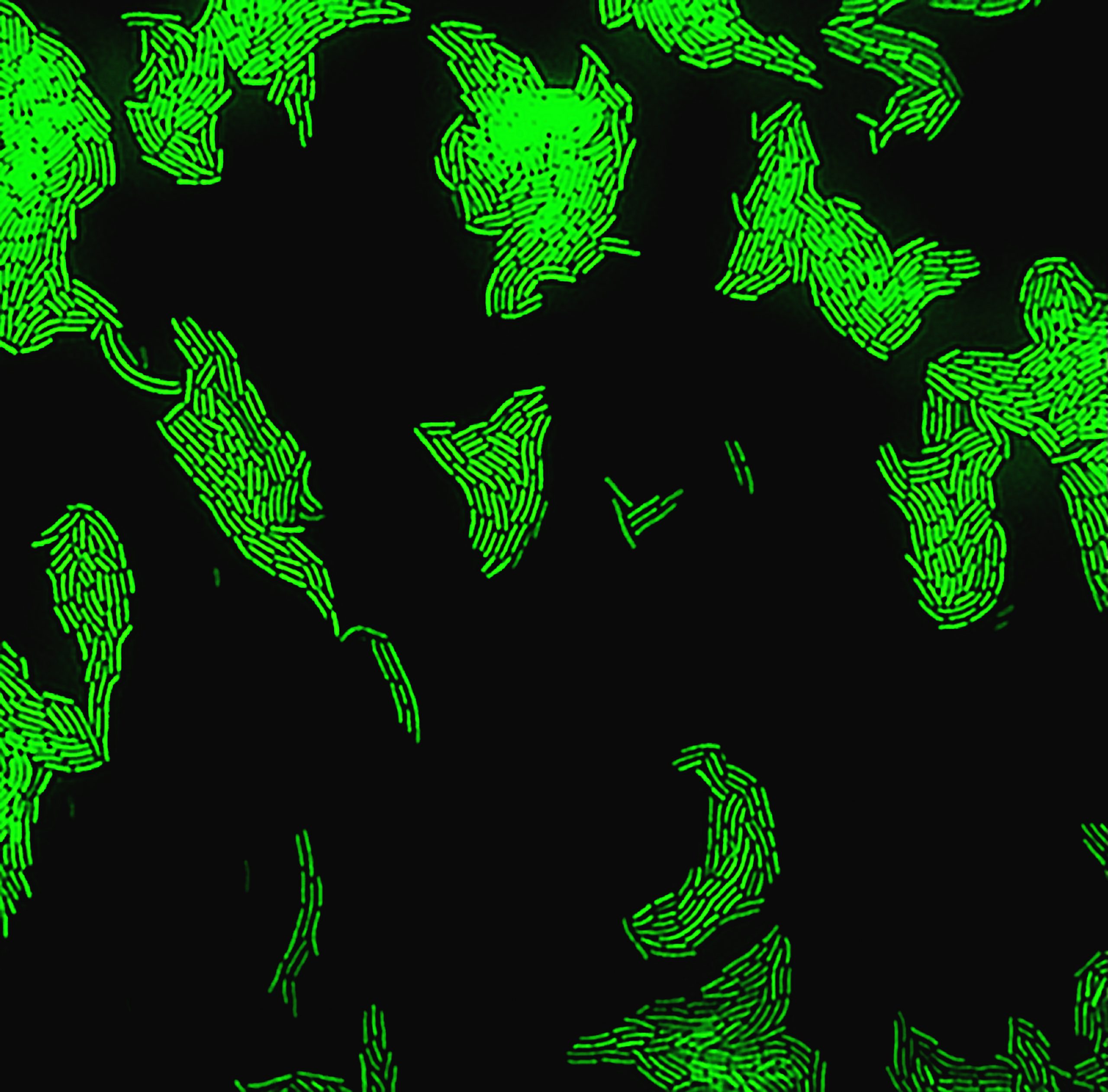
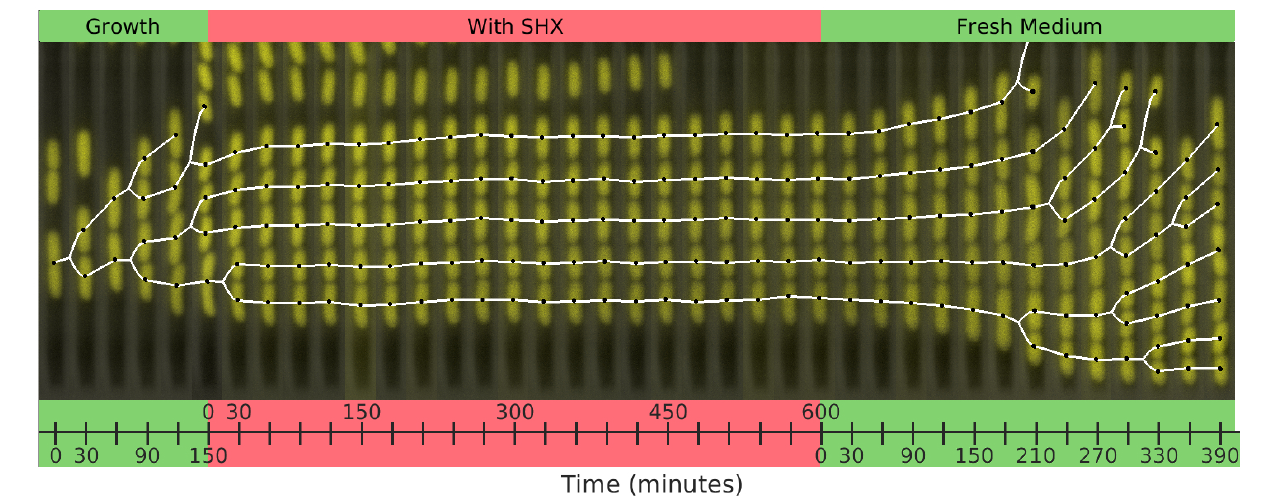
Con el fin de desarrollar un modelo que pueda predecir el comportamiento de las bacterias que experimentan condiciones dramáticas cercanas a la muerte, el equipo de Balaban investigó el comportamiento de las células individuales de una cepa de E-coli, bacterias comúnmente utilizadas en el trabajo experimental de laboratorio. Las variantes silvestres de esta bacteria pueden causar infecciones gastrointestinales graves con complicaciones potencialmente mortales. Las células prósperas recibieron una dosis de una sustancia química (SHX) que induce inmediatamente la inanición. Este estrés agudo, como una gran dosis de antibióticos, no permite que las células establezcan una respuesta adaptativa.
El SHX se aplicó durante diferentes períodos de tiempo en experimentos separados. Después de la retirada de la SHX, se observó la recuperación de células individuales. Las células no se recuperaron todas al mismo ritmo, lo que uno podría esperar en células genéticamente idénticas. En cambio, algunas células se recuperaron rápidamente, en una hora, mientras que otras tardaron mucho más, a veces hasta un día. La duración del tiempo de recuperación también dependía de cuánto tiempo se aplicaba la dosis inicial de SHX, aunque había una dosis máxima más allá de la cual cualquier aumento en el tiempo de aplicación de la SHX no tenía ningún efecto sobre los tiempos de recuperación de las células bacterianas.
Balaban explicó que “esto sugiere que las bacterias guardan un recuerdo de la exposición total a SHX”. Las tasas de recuperación mostraron claramente que el proceso no fue aleatorio. De hecho, parecían similares a las tasas observadas en ciertos procesos físicos que muestran recuperación después de que se ha eliminado un estrés externo, visto, por ejemplo, en algunos plásticos. Mediante el uso de esta analogía, el grupo Balaban, junto con el profesor de la Universidad Hebrea Oded Agam, un experto en física estadística, fueron capaces de modelar el estado interrumpido y predecir el comportamiento de las poblaciones de células en este estado. Es importante destacar que este modelo permite predecir cómo responderá una población bacteriana a un tratamiento con antibióticos.
Según Balaban, una mejor comprensión del estado interrumpido de las bacterias “abre nuevas vías para el desarrollo de mejores tratamientos que permitirán matar no solo a las bacterias en su estado normal, sino también cuando entran en el esquivo estado interrumpido”. De cara al futuro, se pueden explotar efectos similares para matar las células cancerosas de manera más efectiva.
CITATION: Observation of universal “ageing” dynamics in antibiotic persistence. Kaplan Y. et al.
Nature 2021 DOI: 10.1038/s41586-021-04114-w
FUNDING: European Research Council, Israel Science Foundation, Minerva Foundation.